Во взаимоотношениях между организмами матери и плода плацента выполняет роль железы внутренней секреции. В ней происходят процессы синтеза, секреции и превращения ряда гормонов белковой и стероидной структуры. Уже в предимплантационный период на стадии бластоцисты зародышевые клетки секретируют прогестерон, эстрадиол и хорионический гонадотропин, имеющие большое значение для нидации плодного яйца. В процессе органогенеза гормональная активность плаценты возрастает. Затем большие количества гормонов секретируются плацентой в течение всей беременности. Существует тесная взаимосвязь между организмом матери, плода и плацентой в продукции гормонов. Одни из них секретируются самой плацентой и транспортируются в кровь матери и (или) плода. Другие являются производными предшественников, попадающих в плаценту из организма матери и плода. Прямая зависимость синтеза эстрогенов в плаценте от андрогенных предшественников, продуцируемых в организме плода, позволила Е. Diczfalusy (1962) сформулировать понятие о фетоплацентарной системе. Через плаценту могут транспортироваться и неизмененные гормоны. Местом продукции плацентарных гормонов являются синцитио- и цитотрофобласт, а также децидуальная ткань.
Из числа гормонов белковой природы в плаценте обнаружены тиреотропин, АКТГ, меланостимулирующий гормон, релаксин, лютеинизирующий рилизинг-гормон, соматостатин. Плацента синтезирует хорионический гонадотропин, плацентарный лактоген и пролактин, а также иммунореактивный Р-эндорфин, а-меланоцитостимулирующий гормон и пропиомелакортин (предшественник АКТГ). Из гормонов стероидной природы синтезируются гестагены и эстрогены.
Физиологическая роль ряда гормонов плаценты еще не изучена полностью, однако уровень их значительно выше в тканях трофобласта, чем в децидуальной ткани [Demura R. et al., 1982]. Относительно соматостатина плаценты известно, что он идентичен таковым других тканей и сходен с ним по структуре. Соматостатин поступает к плоду и в организм матери и регулирует секрецию плацентарного лактогена, оказывая локальное воздействие на трофобласт [Lee J.N., Chard Т., 1982].
Большое значение в развитии беременности и нормальных взаимоотношений в системе мать — плод имеет плацентарный лактоген (ПЛ). Он обладает активностью пролактина и иммунологическими свойствами гормона роста, оказывает лактогенный и лютеотропный эффект, поддерживая стероидогенез в желтом теле яичника в I триместре беременности. Основная биологическая роль ПЛ заключается в регуляции углеводного и липидного обменов, усилении синтеза белка в организме плода, от чего в определенной мере зависит масса плода. Влияние на процессы метаболизма плода и организма матери связано также с усилением задержки азота, возрастанием содержания жирных кислот, увеличением толерантности к гипогликемическому действию инсулина [Kyank Н., Dassler С. G, 1977].
ПЛ синтезируется клетками трофобласта. Его структура представлена одной полипептидной цепью; по структуре он близок к гормону роста. Молекулярная масса его 21000—23 000. ПЛ поступает в организм матери, где быстро метаболизируется. Период его полураспада короткий: при низкой концентрации гормона он колеблется в пределах от 11 до 13 мин, при высокой — от 25 до 30 мин [Kasai К. et al., 1982]. Чрезвычайно короткий период полужизни (20 мин), отсутствие суточной ритмики секреции и наличие единственного источника его синтеза (плацента) позволяют использовать ПЛ для диагностики функционального состояния этого органа. ПЛ выявляется в крови матери уже с 5—6-й недели беременности (табл. 11).
Концентрация ПЛ возрастает в 10 раз к 12 нед. беременности, т. е. к моменту формирования плаценты. В период от 12 до 16 нед беременности вновь наблюдается значительный подъем уровня ПЛ в сыворотке крови матери: концентрация его становится в 38 раз выше по сравнению с началом беременности. Это свидетельствует о продолжающемся развитии плаценты. В дальнейшем концентрация ПЛ продолжает увеличиваться, достигая максимума в 35—36 нед. К моменту родов наступает умеренное снижение уровня ПЛ, отражающее начало регрессивных изменений в плаценте.
ПЛ практически не проникает к плоду. В околоплодных водах уровень ПЛ в 8—10 раз ниже, чем в крови матери [Nielsen P. V., Schioler V., 1981]. Отмечена прямая зависимость между уровнем ПЛ в крови матери и амниотической жидкости, между содержанием гормона в крови и массой плода и плаценты. Это послужило основанием для оценки состояния плаценты и плода по уровню ПЛ в крови и в околоплодных водах.
Для развития беременности важен и чисто плацентарный гормон — хорионический гонадотропин (ХГ), являющийся продуктом синцитиотрофобласта. ХГ относится к гликопротеидам, имеет молекулярную массу 36 000—40 000, по строению и биологическому действию сходен с лютеинизирующим гормоном (ЛГ). Он состоит из двух субъединиц (а- и в-ХГ) — мономеров, образующихся при диссоциации ХГ. Биосинтез каждой из них зависит от индивидуального гена и осуществляется на полирибосомах синцитиотрофобласта. а-и в-субъединицы различаются по углеводному и аминокислотному составу и биологическому значению. Наряду с ХГ наиболее точно функцию плаценты отражает в-ХГ [Sandvei R. et al., 1981; Seppale M. et al., 1981]. В ранние сроки ХГ стимулирует стероидогенез в желтом теле яичника. Во второй половине беременности ХГ стимулирует синтез эстрогенов в плаценте, участвуя в ароматизации андрогенов. Существует мнение, что ХГ усиливает стероидогенез в коре надпочечников плода, а также тормозит сократительную активность миометрия. ХГ может участвовать в механизмах дифференцировки пола плода [Dorner G., 1970].
В конце беременности и при некоторых ее осложнениях в крови обнаруживаются особые формы субъединиц ХГ — так называемые свободные субъединицы а- ХГ и в-ХГ [Benveniste R., Scommegna А., 1981]. Они являются предшественниками зрелых форм молекулы ХГ, и их появление связывают со старением плаценты, эндокринопатиями и трофобластическими опухолями.
ХГ, как и ПЛ, транспортируется преимущественно в кровь матери. В крови плода его уровень в 10—20 раз ниже, чем в крови беременной.
В крови беременных женщин ХГ находят сразу после имплантации плодного яйца. С прогрессированием беременности уровень его в крови повышается, удваиваясь в каждые 1,7—2,2 дня в течение 30 дней. К 8— 10-й неделе отмечается максимальная концентрация его в крови, которая варьирует в пределах 60—100 МЕ/мл. Во II триместре содержание ХГ в крови постоянно находится на невысоком уровне (10 МЕ/мл), в III триместре несколько возрастает. Выделение ХГ с мочой начинается со 2-й недели беременности и достигает наивысшего уровня в 10—12 нед. Далее происходит постепенное снижение количества ХГ в моче. Динамика концентрации его в моче коррелирует с таковой в крови. При 5-недельной беременности ХГ выделяется с мочой в количестве около 1500— 2500 МЕ/л, в 7—8 нед —5000—15 000 МЕ/л, в 10— И нед —80 000— 100 000 МЕ/л, а в 12—13 нед — 20 000 МЕ/л. В последующие сроки уровень ХГ в моче находится в пределах 10 000—20 000 МЕ/л.
Присутствие (3-ХГ в плазме крови выявляется с 1-й недели беременности. Содержание его быстро увеличивается в период до 6 нед и в 7—9 нед держится на постоянном уровне. Максимум концентрации Р-ХГ наблюдается в 11 нед, т. е. несколько позже, чем ХГ, и снижается к 16 нед [Harrison R. F. et al., 1980].
В последние годы установлено, что ткань хориона и децидуальная оболочка продуцируют пролактин [Richards S. R. et al., 1982]. Об этом свидетельствует высокое (в 10—100 раз большее, чем в крови) содержание этого гормона в околоплодных водах. Существует и другое мнение о продукции и транспорте пролактина в плаценте. Исследования с использованием меченой флюоресцирующей высокоспецифичной антисыворотки [Каsai К. et al., 1982] показали, что пролактин локализуется главным образом в межклеточном пространстве компактного слоя децидуальной ткани и в синцитии трофобласта. В цитоплазме децидуальных клеток и цитотрофобласте флюоресценция отсутствует. На основании этого было высказано предположение, что пролактин синтезируется в синцитиотрофобласте, а затем переходит в межворсинчатое пространство, из которого с током крови переносится в децидуальную ткань.
Во время беременности, помимо плаценты, пролактин синтезируется гипофизом матери и плода, поэтому в крови матери циркулирует одновременно пролактин и плацентарного, и гипофизарного происхождения.
Физиологическая роль пролактина определяется его структурным сходством с ПЛ. Он играет определенную роль в продукции легочного сурфактанта и фетоплацентарной осморегуляции [Tyson J. Е., 1980]. Последнее обусловлено наличием биологической и иммунологической активности пролактина, связанной с регуляцией осмотических процессов в стенке амниона [Tomita К. et al., 1982]. Содержание пролактина в сыворотке крови матери прогрессивно возрастает в процессе беременности, особенно в 18—20 нед и перед родами. Иная тенденция имеет место в околоплодных водах, где в I триместре концентрация гормона равняется 10 000 нг/мл, а в конце III триместра — 1000 нг/мл. В б нед уровень его в крови составляет 13,58 нг/мл, в 10 нед — 24,8±2,4 нг/мл, в 15 нед—52,46 нг/мл и перед родами — 207±46,8 нг/мл [Riss P. et al., 1980; Skaiba P., Rozmus M., 1981].
Относительно других гормонов белковой природы, выделенных из плаценты, мнения ученых расходятся.
Вопросы биосинтеза стероидных гормонов и участия в нем плаценты наиболее изучены.
Из стероидных гормонов плацентарное происхождение имеет прогестерон. Биологическая роль его в развитии беременности велика. Он участвует в имплантации плодного яйца, подавляет сокращения матки и поддерживает тонус истмико-цервикального отдела, стимулирует рост матки при беременности и участвует в стероидогенезе. Прогестерон обладает способностью накапливаться во многих тканях, создавая тем самым своеобразное гормональное депо, что имеет большое значение в поддержании концентрации его в крови на необходимом уровне. По данным Р. К. Suteri и соавт. (1977), он оказывает иммунодепрессивное действие, что также очень важно для развития плодного яйца (подавление реакции отторжения).
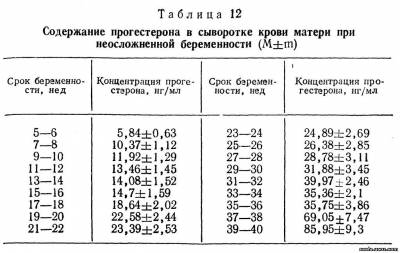
Из холестерина, содержащегося в крови матери, в плаценте образуются прегненолон и прогестерон. Последний поступает в основном в кровь матери, и лишь 1/4— 1/5 часть его попадает к плоду. В организме матери (в основном в печени) он быстро подвергается метаболическим превращениям и около 10—20 % его выделяется с мочой в виде прегнандиола. В надпочечниках и печени плода прогестерон превращается в нейтральные стероиды (главным образом в дегидроэпиандростерон — ДЭА и его производные), которые с кровью плода поступают в плаценту и через андростендион и тестостерон трансформируются в эстрогены. Прогестерон синтезируется в синцитиотрофобласте уже в ранние сроки беременности, однако ведущая роль плаценты в продукции этого гормона выявляется в 5-6 нед.. До этого срока основное количество гормона вырабатывается желтым телом беременности, и в 5—6 нед концентрация прогестерона в сыворотке крови беременных уже значительно превышает таковую у не беременных женщин во вторую фазу менструального цикла (табл. 12). К 7—8-й неделе беременности концентрация прогестерона возрастает вдвое и продолжает постепенно повышаться к 37—38 нед и перед родами.
Продукция гормона в I триместре беременности составляет 25—50 мг/сут, во II триместре — уже 75— 255 мг/сут и в конце— 180—565 мг/сут, причем ХГ не оказывает регулирующего действия на синтез прогестерона в плаценте.
С развитием беременности возрастает экскреция прегнандиола с мочой. Однако корреляция между концентрацией прогестерона в крови и прегнандиола в моче отсутствует [Баграмян Э. Р. и др., 1976].
К стероидным гормонам плаценты относятся эстрогены (эстрадиол, эстрон и эстриол). Они различаются по своему строению и биологической активности. Эстрогены воздействуют на обменные процессы и рост матки, вызывая гиперплазию и гипертрофию эндометрия и миометрия, принимают активное участие в развитии родового акта. Непосредственное влияние эстрогенов на плод изучено недостаточно. Полагают, что плод связывает эстрогены и они способствуют его росту [Гармашева Н. Л., Константинова Н. Н., 1978].
Местом выработки эстрогенов является синцитиотрофобласт. Продукция их находится в прямой зависимости от состояния маточно-плацентарного кровообращения и наличия предшественников, вырабатываемых в организме матери и плода. Эстрогены по праву относятся к гормонам фетоплацентарного комплекса. В начале беременности, когда масса трофобласта невелика и продукция стероидов в нем недостаточна, основное количество эстрогенов вырабатывается в надпочечниках матери и желтом теле яичника. В 12—15 нед продукция эстрогенов резко возрастает, а среди фракций начинает превалировать эстриол. Позже 20 нед беременности образование эстрогенов осуществляется преимущественно в плаценте при активном участии плода. Прослеживается зависимость секреции эстрогенов у беременных от функции гипоталамо-гипофизарно-надпочечниковой системы матери и плода [Breckwoidt М., Reck G., 1983].
Синтез эстрогенов изучен достаточно подробно. Он осуществляется в плаценте из C-19-андрогенных стероидов д4-андростендиола, дегидроэпиандростерона, 16 а-ОН-дегидроэпиандростерона, тестостерона и др.) под влиянием ароматизирующих ферментных систем, содержащихся в микросомах синцитиотрофобласта.
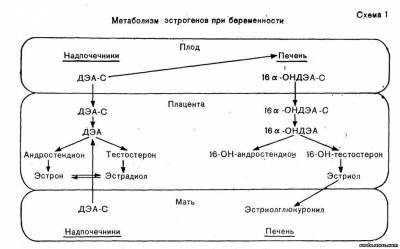
Определенная роль в ароматизации андрогенов в плаценте принадлежит ХГ, в то время как АКТГ плода является регулятором продукции собственных андрогенов. Большинство андрогенных предшественников эстрогенов продуцируется в коре надпочечников плода и в незначительных количествах в надпочечниках матери из прегненолона (в основном плацентарного происхождения и частично синтеризованного в надпочечниках плода). В надпочечниках плода и матери 17-оксипрегненолона сульфат превращается в дегидроэпиандростерона сульфат (ДЭА-С). Некоторое количество ДЭА-С поступает в плаценту, а большая часть его — в печень и другие ткани плода, где превращается в 16а-оксидегидроэпиандростерона сульфат (16а-ОНДЭА-С), который также поступает в плаценту (схема 1). В плаценте имеется активная система сульфатаз, под влиянием которой эти сульфосоединения с большой скоростью гидролизуются до свободных соединений — ДЭА и 16а-ОНДЭА. Они являются непосредственными предшественниками в плаценте эстрона и эстрадиола (ДЭА) и эстриола (16а-ОНДЭА).
В плаценте свободный ДЭА превращается в андростендион и тестостерон, основное количество которых превращается соответственно в эстрон и эстрадиол. Следует отметить, что участие матери и плода в общей секреции ДЭА приблизительно одинаково, в связи с чем продукция этих гормонов зависит от функции надпочечников как плода, так и матери. Плацента не содержит 16-гидролазы и не способна к 16-гидроксилированию, поэтому в ней не происходит дальнейшей трансформации эстрона и эстрадиол а, которые попадают в кровь матери и плода.
Основной предшественник эстриола (см. схему 1) — 16-ОНДЭА-С, который вырабатывается в тканях плода (4 части) и в меньшей мере в надпочечниках матери (1 часть). Попадая в плаценту, это соединение подвергается гидролизу и превращается в 16-ОН-андростендион и 16-ОН-тестостерон. Последние соединения в свою очередь переходят в 16-ОН-эстрон и в 16,ОН-эстрадиол, т. е. эстриол, который из плаценты поступает в кровь матери и плода. Поскольку секреция эстриола зависит в основном от андрогенных предшественников, продуцируемых в надпочечниках плода, уровень этого гормона в организме беременной отражает состояние не только плаценты, но и плода. Однако снижение сульфатазной активности плаценты тормозит синтез эстрогенов.
Метаболизм эстрогенных гормонов в организме матери и плода заключается в основном в конъюгации их с остатками глюкуроновой и серной кислот и образовании глюкуронидов и сульфатов, причем метаболизм их у плода происходит в основном с образованием сульфатов. В метаболизме гормонов, помимо печени, участвуют слизистая оболочка кишечника и почки. Таким образом, в крови матери и плода содержатся неконъюгированные формы эстрогенов, количество которых не зависит от состояния печени, кишечника и функции почек и отражает функцию плаценты и фетоплацентарной системы. Почки зкскретируют только конъюгированные формы гормона. На их содержание в моче матери и плода, а следовательно, и в околоплодных водах оказывает влияние состояние печени, почек и слизистой оболочки кишечника обоих организмов. Кроме того, поскольку процесс дисульфирования ДЭА-С в плаценте происходит с большой скоростью, которая зависит от величины и метаболической активности плаценты, величина клиренса ДЭА-С может отражать также функцию плаценты.
Переход стероидных гормонов через плацентарную мембрану имеет особенности. Гидрофобные и жирорастворимые стероиды проникают через липопротеиновые поля, а гидрофильные стероиды — через водосодержащие поры. Кроме того, отмечается распределение отдельных фракций эстрогенов между организмами матери и плода, которое сходно с таковым для ХГ и ПЛ. Так, уровень эстрадиола в материнской крови почти в 272 раза превышает концентрацию этого гормона в крови пуповины.
В первые недели беременности экскреция эстрогенов с мочой и содержание их в крови находятся на уровне, соответствующем активной фазе желтого тела у не беременных. С 12—15 нед продукция и содержание эстрогенов в моче возрастают в 5—10 раз и среди фракций начинает превалировать эстриол.
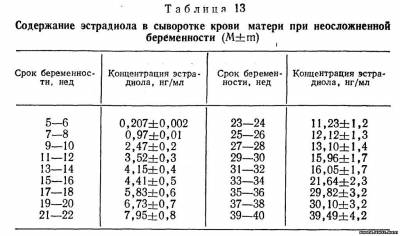
В конце беременности количество эстрогенов увеличивается в 1000 раз по сравнению с исходным состоянием. Ежедневно плацента продуцирует до 50 мг эстрогенов; при этом на долю эстриола приходится 80 % эстрогенов, экскретируемых с мочой. Функция плаценты в большей мере зависит от концентрации эстрогенов в крови. Среди трех фракций наименьшее значение имеет эстрон. Содержание эстриола в сыворотке крови беременных женщин подвержено значительным колебаниям. Уровень его в сыворотке крови возрастает от 0,3—9,7 нг/мл (в 15 - 20 нед) до 4,5- 14,7 нг/мл (к 36— 40 нед).
Содержание эстрадиола в сыворотке крови в начале беременности соответствует таковой у не беременных женщин в период овуляции. При нормально развивающейся
беременности отмечаются резкий подъем уровня его (в 12.5 раз) к 9—10 нед и затем постепенное увеличение до конца беременности (табл. 13) с тремя пиками более высокой концентрации: в 23—24, 35—36 и 39—40 нед беременности (табл. 13).
Сопоставление содержания в крови ПЛ, прогестерона (П) и эстрадиола (Эд) показало, что практически на протяжении всей беременности концентрация П преобладает над уровнем эстрадиола. Это преобладание особенно выражено в сроки до 7—8 нед, когда соотношение П/Эд составляет от 30 до 10,7. В дальнейшем величина П/Эд снижается до 4,8 при 9—10 нед и стабильно держится на уровне 2—1,2 с 23—24 нед до конца беременности. Концентрация ПЛ значительно выше уровня П и Эд. Преобладание активности ПЛ при стабилизации соотношения П и Эд в сроки беременности от 23—24 до 35—36 нед, по-видимому, является условием, определяющим рост и развитие плода в этот период. Анализ соотношения П/Эд показал, что существовавшее ранее пред¬положение о преобладании в крови уровня эстрогенных гормонов над прогестероном не может считаться одной из причин наступления родов.
Концентрация тестостерона в сыворотке крови у здоровых беременных варьирует в небольших пределах — от 0,4 до 0,8 нг/мл (с 5—6 до 19—20 нед). Наблюдаются снижение уровня этого гормона до 0,28 нг/мл к 23—24 нед., затем постепенный подъем концентрации тестостерона в период до 32 нед. и последующее падение до 0,11 нг/мл к концу беременности. Снижение концентрации тестостерона в крови при беременности 23—24 нед и после 31—32 нед совпадает с увеличением концентрации эстрадиола в крови. Это может быть обусловлено усилением синтеза последнего в плаценте из его непосредственного предшественника — тестостерона.
Таким образом, гормонпродуцирующая функция плаценты определяет основные физиологические процессы в системе мать—плацента—плод.