Неблагоприятное влияние сердечно-сосудистой патологии на течение беременности и развитие плода, а также гипертонической болезни и гипотонии отмечено многими авторами. Нарушения обменных процессов, связанные с недостаточностью кровообращения, приводят к рождению детей с пониженной массой, мышечной гипотонией и гипотрофией.
Морфологическими изменениями в плаценте при сердечно-сосудистой патологии являются дистрофические и циркуляторные нарушения, степень и распространенность которых зависят от тяжести заболевания. В отличие от других видов патологии сердечно-сосудистые заболевания не сопровождаются нарушением созревания плаценты.
У таких больных макроскопически плаценты имеют большие размеры, массу свыше 660 г, плацентарно-плодовый коэффициент находится в пределах 0,2—0,25. Ткань плаценты мясистая, темно-красного цвета, дольки неравномерной величины, местами нечетко очерчены. На материнской поверхности часто встречаются множественные мелкие сгустки крови.
Микроскопически при нарушении кровообращения II—III стадии в эпителии амниона выявляются дистрофические и некробиотические изменения ядра и цитоплазмы. Клетки уплощены, кубической формы. В цитоплазме снижено содержание РНК. Строма амниона отечна, а хориальной пластины фиброзирована. Просвет сосудов хориальной пластины и стволовых ветвей хориона тромбирован. Стенки сосудов утолщены, с явлениями плазматического пропитывания и гиалиноза. Внутренняя оболочка сосудов утолщена, иногда с увеличением количёства клеточных элементов. Эндотелий набухший, находится в состоянии пролиферации.
Строма крупных и средних ворсин фиброзирована, с участками накопления кислых высокополимерных глюкозаминогликанов. Среди клеточных элементов стромы преобладают фибробласты. Встречаются «юные» ворсины-регенераты, количество которых существенно не превышает таковое при неосложненной беременности.
Терминальные ворсины мелкие (диаметром 10— 30 мк), часто образуют скопления, тесно прилегающие друг к другу, в связи с чем происходит сужение межвор¬синчатого пространства. В таких ворсинах много капилляров, расположенных по периферии, резко расширенных, с образованием ангиоматозных структур. Субэндо- телиальные и субэпителиальные мембраны утолщены, при импрегнации серебром выявляются участки их расплавления. Часть мелких ворсин полностью лишена эпи¬телия. В строме таких ворсин накапливаются кислые высокополимерные гликозаминогликаны и отсутствуют клеточные элементы. Местами скопления мелких ворсин замурованы среди масс фибриноида. Встречаются мелкие участки некроза ворсин (анемические инфаркты) и небольшие тромбы в межворсинчатом пространстве. В островках цитотрофобласта преобладает фибриноид.
Хориальный эпителий однослойный. Синцитиотрофобласт узкий, с мелкими вытянутыми ядрами, неравномерно расположенными по окружности. Много синцитиальных узлов, функционирующих и с дистрофическими изменениями.
В синцитиотрофобласте заметно снижена реакция на РНК и карбоксильные группы. Активность SH- и SS- групп снижена неравномерно. Сохраняется высокая активность щелочной фосфатазы (в функционирующих синцитиальных узлах и в синцитии неповрежденных ворсин). Активность СДГ, НАД-Н и цитохромоксидазы снижена. Активность лактат- и малатдегидрогеназ сохранена.
Изменения децидуальной базальной оболочки особенно выражены при гипертонической болезни [Жемкова 3. П., Топчиева О. И., 1978]. Она узкая, содержит крупные и мелкие децидуальные клетки с вакуолизацией ядра и цитоплазмы. В строме заметны множественные очаги некроза и кровоизлияния, значительные отложения извести, небольшие скопления лимфоидных элементов. Стенки сосудов децидуальной оболочки утолщены, с участками фибриноидного некроза и плазморригиями.
По данным Е. П. Калашниковой (1969), ревматические пороки сердца не сопровождаются специфическими изменениями в плаценте даже у беременных с клиническими проявлениями обострения заболевания.
При электронной микроскопии плацент женщин с артериальной гипертонией беременных I, II и III стадии и с нейроциркуляторной дистонией по гипертоническому типу А. С. Бергман и соавт. (1977) обнаружены следующие изменения плаценты. Количество микроворсин, покрывающих поверхность синцития, меньше, чем в норме, местами отмечается их деструкция. В цитоплазме синцития митохондрии в стадии необратимого набухания, много вакуолей, сконцентрированных вокруг ядра. Контуры ядер клеток неровные, внутренняя мембрана утолщена, ядрышки пикнотические. Местами гранулярная зндоплазматическая сеть расширена с образованием цистерн.
При гипертонической болезни II—III стадии возрастают количество и размеры клеток Лангханса с большим количеством органелл. Митохондрии частично не изменены, а частично набухшие с просветленным матриксом и очаговым исчезновением крист. Базальная мембрана трофобласта утолщена с гиалинизацией основного вещества стромы. В клеточных элементах стромы ворсин отмечены гибель митохондрий и разрушение цитоплазматической сети. Эндотелий сосудов при гипертонической болезни I стадии не имеет отклонений от нормы. При гипертонической болезни II—III стадии цитоплазматическая сеть клеток эндотелия расширена, цитоплазма содержит много крупных вакуолей, рибосом и полисом. Вместе с тем выявляется уплотнение базальной мембраны сосудов и основного вещества в периваскулярном пространстве.
При нейроциркуляторной дистонии по гипертоническому типу структурные элементы плацентарного барьера значительно изменены. Наблюдается резкое уменьшение количества микроворсин, покрывающих поверхность синцития. Митохондрий в цитоплазме синцития мало, большинство из них находится в стадии необратимого набухания, имеются миелоподобные структуры и участки гомогенизации. Количество свободных рибосом и полисом уменьшено. Ядра синцития пикнотичы и сморщены. Базальная мембрана трофобласта утолщена и уплотнена. Наряду с этими изменениями определяется расширение гранулярной цитоплазматической сети с образованием круглых цистерн. Клетки эндотелия местами разрушены. В клетках Лангханса, обнаруживаемых главным образом при электронной микроскопии, цитоплазматическая сеть расширена, имеется много крупных митохондрий, свободных рибосом и полисом.
В морфогенезе плаценты при тяжелых нарушениях кровообращения имеют значение изменения в организме беременной женщины. Глубокие нарушения метаболизма способствуют повреждению плацентарного барьера и в первую очередь синцитиотрофобласта, субэндотелиальных мембран. Несмотря на компенсаторные реакции на субклеточном (расширение эндоплазматической сети, увеличение числа рибосом и полисом) и тканевом (гиперплазия капилляров, увеличение количества синцитиокапиллярных мембран) уровнях, страдают газообмен и транспорт питательных веществ, а также гормональная функция плаценты. Уровень эстрадиола при гипертонической болезни после 20 нед беременности почти не повышается. В период от 26 до 34 нед, когда в норме наблюдается максимальная гормональная активность плаценты, происходит незначительный подъем экскреции эстриола, но в дальнейшем она не увеличивается. Разница в экскреции прегнандиола у здоровых и больных женщин незначительна, за исключением 37-й недели беременности, когда обнаруживается снижение уровня его экскреции.
Острые и хронические инфекции. Инфекционные заболевания беременной оказывают неблагоприятное влияние на плод как путем непосредственного проникания возбудителей к зародышу, так и благодаря токсическому воздействию на фетоплацентарный комплекс. Помимо острых и хронических инфекционных заболеваний, на плод и плаценту могут влиять очаги воспаления в глотке, миндалинах, мочевыделительной системе и половых органах. По мнению С. М. Беккера (1975), разнообразные инфекционные заболевания и очаги латентной инфекции вызывают прерывание беременности в различные сроки у 43 % женщин. Перинатальная смерть при инфекциях у матери находится в пределах от 20 до 42,2 %.
При внутриутробном инфицировании возбудители инфекции проникают к плоду трансплацентарно (гематогенным путем), контактным путем (восходящим или нисходящим)—при разрыве плодного пузыря, а иногда и при целом плодном пузыре. Описаны также нисходящий (через маточные трубы) и смешанные пути распространения инфекции. Через плаценту могут проникать почти все известные возбудители инфекции (бактерии, вирусы, риккетсии, грибы, микоплазмы и др.). Некоторые бактериальные (колибактериальная стафилококковая), изредка вирусные (вирус простого герпеса) и микотические (грибы рода кандида) инфекции распространяются преимущественно восходящим путем. Особенно велика опасность восходящей инфекции при несвоевременном излитии околоплодных вод. При нарушении целости плодного пузыря уже к концу 1-х суток происходит почти полное инфицирование околоплодных вод.
Характер морфологических изменений плаценты при инфекционной патологии зависит от времени и путей заражения, а также вида возбудителя. Заражение в I триместре беременности нередко приводит к развитию эмбриопатий, тератогенному влиянию и возникновению самопроизвольного аборта. В этот период специфические особенности, характеризующие вид возбудителя, часто не выявляются. Во второй половине беременности заражение может сопровождаться развитием инфекционных фетопатий, имеющих при некоторых видах возбудителя специфические черты.
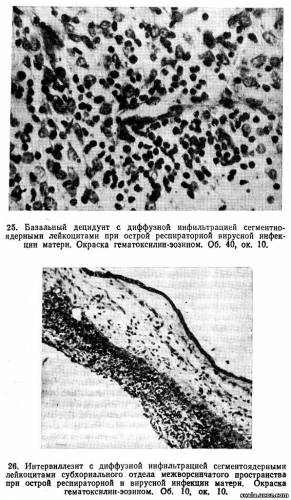
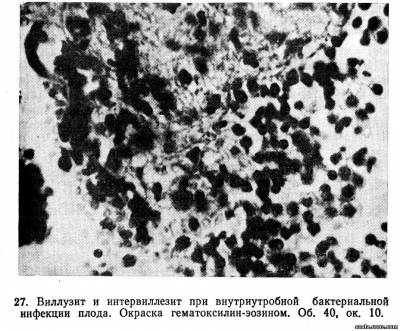
Локализация воспалительных изменений в плаценте зависит от пути заражения. При гематогенном пути распространения возбудитель инфекции проникает в плаценту через сосуды отпадающей децидуальной оболочки и вызывает воспаление последней (базальный децидуит; рис. 25), а также межворсинчатого пространства (интервиллезит; рис. 26) и ворсин хориона (виллузит) (рис. 27).
При вторичном гематогенном заражении (инфекция распространяется от плода) воспалительные изменения развиваются прежде всего в амнионе и хориальной пластине (плацентарный хориоамнионит). В этих случаях воспалительный процесс часто сочетается с субхориальным интервиллезитом и воспалением стенок ветвей сосудов пуповины — вены и артерий. Воспалительный процесс, захватывающий все слои плаценты, называется плацентитом.
При восходящем пути заражения воспалительные инфильтраты прежде всего обнаруживаются в плодных оболочках и пуповине. Возникают париетальный амнионит, париетальный хориоамнионит (поражение гладкого хориона), париетальный децидуит. Воспаление всех трех оболочек носит название «мембранит». Воспаление пуповины (фуникулит) протекает с воспалительной инфильтрацией стенок вены (флебит). Реже в патологический процесс вовлекаются артерии.
Нисходящий путь инфицирования наблюдается сравнительно редко. Возбудители инфекции проникают через маточные трубы либо в базальную пластину, либо в плодные оболочки и околоплодные воды, а в дальнейшем распространяются по восходящему типу.
Масса плаценты при внутриутробном инфицировании колеблется от 450 до 700 г, плодово-плацентарный коэффициент составляет 0,1—0,14. Макроскопически плацента окрашена неравномерно, с участками темно-красного и желтовато-сероватого цвета, дрябловатой консистенции. Дольки средней величины, чаще без четких границ.
При микроскопическом исследовании общая картина поражения плаценты, помимо воспалительных измене-ний, складывается из дистрофических и циркуляторных нарушений в сочетании с признаками незрелости. При некоторых инфекциях незрелость плаценты выражена особенно резко (сифилис, токсоплазмоз).
Неспецифические изменения плаценты, вызванные различными возбудителями, заключаются в следующем. Клетки эпителия амниона уплощены, с нечеткими грани-цами, явлениями некробиоза, цитоплазма базофильная, с вакуолями. Строма амниона неравномерно отечная. Строма стволовых ворсин плотная, умеренно фиброзиро- вана. Стенки сосудов плода утолщены. Эндотелий набух-ший, пролиферирует. Просвет сосудов может быть час¬тично облитерирован и тромбирован. Терминальных вор¬син много, часть из них крупного диаметра. Местами обнаруживаются большие группы терминальных ворсин различной величины, тесно прилежащих друг к другу и имеющих густоклеточную строму, в которой преоблада¬ют фибробласты, фиброциты и лимфоидные элементы. От «густоклеточных» ворсин при гемолитической болез¬ни они отличаются отсутствием большого количества клеток Кащенко—Гофбауэра и элементов эмбрионально¬го кроветворения. Кислые высокополимерные полисаха¬риды выявляются в строме ворсин, лишенных эпителия и замурованных среди фибриноидных масс. При импрег-нации серебром в группах ворсин, лишенных эпителия, выявляется расплавление аргирофильного каркаса. Встречаются группы «юных» ворсин-регенератов.
Хориальный эпителий однослойный, узкий, с вытяну-тыми ядрами, расположенными неравномерно. В «густо-клеточных» ворсинах иногда встречаются клетки Ланг- ханса; синцитиотрофобласт в таких ворсинах может быть широким, с равномерным расположением округлых ядер клеток. Синцитиальные почки в умеренном количестве, синцитиальных узелков много, но местами преобладают узелки нефункционириующие, с дистрофией и обызвест-влением ядер.
Капилляры располагаются ближе к периферии, мес-тами расширены, с образованием синусоидов, просвет их выполнен кровью. Эндотелий набухший, пролиферирует.
В «густоклеточных» ворсинах капилляры преиму-щественно узкие, отделены от эпителия прослойкой стромы с обилием клеточных элементов. Синцитиокапиллярные мембраны различной толщины, располагаются неравномерно.
Количество РНК в синЦитиотрофобласте сйиікенб, йб в функционирующих синцитиальных узлах и в островках цитотрофобласта иногда наблюдается обильная ШИНе-положительная, базофильная зернистость. В функционирующих синцитиальных узлах и в неповрежденном синцитиотрофобласте обнаруживается высокая активность щелочной фосфатазы, сохранена активность окислительно-восстановительных ферментов. В синцитии снижено содержание карбоксильных групп, активность СДГ, НАД-Н, цитохромоксидазы, но отмечаются высокая активность сульфгидрильных и дисульфидных групп и интенсивная реакция на общий белок.
Базальная децидуальная оболочка неравномерной толщины, с некробиотическими изменениями децидуальных клеток, иногда с преобладанием вытянутых мелких децидуальных элементов. В строме имеются кровоизлияния, очаги некроза; стенки сосудов утолщены, просвет их тромбирован.
Из вирусных инфекций при микроскопическом исследовании наиболее характерную картину дает цитомегалия. Вирус цитомегалии относится к герпетическим вирусам (подгруппа В). Он обладает цитопатическим действием. Некоторые авторы считают, что плод инфицируется вирусом лишь при первичной инфекции матери во время беременности. На ранних стадиях цитомегалии в строме ворсин обнаруживают очаги воспаления с некрозом в центре. Среди воспалительных элементов преобладают моноциты и нейтрофильные лейкоциты. Выявляются одиночные цитомегалы — крупные клетки с эозинофильными внутриядерными включениями, которые отделены от ядерной мембран светлой зоной. Р. П. Пьянов (1974) обнаружил группы цитомегалов в строме ворсин и в просвете сосудов плаценты. Иногда встречаются преимущественно плазмоклеточные инфильтраты, а нейтрофилы, моноциты и цитомегалы отсутствуют. Возможно, такие формы соответствуют более поздней фазе болезни. Для цитомегалии не характерны явления интервиллезита.
При вирусном гепатите, вызванном вирусами А, В или С, изменения наиболее выражены в межворсинчатом пространстве (тромбозы, распространенная инфильтрация сегментоядерными лейкоцитами). При рождении живых детей отмечают в первую очередь повреждение базальной пластины: дистрофию, некроз, очаги периваскулярной инфильтрации лимфоидными клетками. В ворсинах отсутствуют воспалительные инфильтраты, но наблюдается пролиферация клеток стромы.
Внутриутробное инфицирование плода вирусом простого герпеса II типа (реже I типа) происходит во время прохождения его через родовые пути при наличии генитального герпеса у матери. Трансплацентарный путь заражения чаще встречается в ранние сроки беременности и сопровождается самопроизвольным абортом. Возможно именно вследствие этого в литературе имеются лишь единичные сообщения относительно изменений плаценты при данном заболевании [Гулькевич Ю. и др., 1968]. Вирус простого герпеса обладает цитопатическим действием. Отмечено появление множественных мелких очагов дистрофии и некроза с характерными эозинофильными включениями в ворсинчатом хорионе.
Э. Поттер (1971) описала очаги некроза ворсин с клеточной инфильтрацией при внутриутробном заражении ветряной оспой.
Несмотря на то что достоверно доказана трансплацентарная передача вируса краснухи даже при бессимптомном течении инфекции у матери, изменения в плаценте при этой инфекции выражены слабо и носят неспецифическй характер [Altshuler G., McAdams A J., 1972].
Известны внутриутробные заболевания плода, вызванные энтеропатогенными вирусами (ECHO, Коксаки В, полиомиелита), но изменения плаценты в этих случаях не отмечены.
Относительно поражения плаценты при трансплацентарной передаче вирусных респираторных инфекций (грипп, парагрипп, респираторно-синцитиальный вирус, аденовирус) мнения ученых противоречивы. Полагают, что вирус гриппа не вызывает повреждения плаценты. Некоторые исследователи не находят воспалительных изменений, но указывают на циркуляторные нарушения в матке и плаценте. Другие авторы описывают на фоне нарушения кровообращения развитие распространенных воспалительных изменений в виде децидуита, субхориального интервиллезита, васкулита в хориальной пластине, париетального хориоамнионита, фуникулита.
При антенатальной гибели плода в случаях острой респираторной инфекции у матери В. И. Грищенко и А. Ф. Яковцева (1978) обнаружили нарушения гемодинамики с гиперемией, стазом, множественными диапедезными кровоизлияниями в децидуальной оболочке, тромбоз межворсинчатого пространства. В децидуальной оболочке на фоне отека, некробиоза, фибриноидного некроза была усилена лимфоидная инфильтрация с примесью плазматических клеток. Воспалительные инфильтраты распространялись на прилежащую часть межворсинчатого пространства и строму ворсин (базальный интервиллезит, виллузит). Во всех наблюдениях обнаружены мелкие и обширные псевдоинфаркты и анемические инфаркты. В синцитиотрофобласте выявлены некробиотические изменения в сочетании с очаговой пролиферацией и увеличением синцитиальных узелков. В сосудах ветвистого хориона были выражены отек, склероз, пролиферация с облитерацией просвета, тромбоз. В отдельных случаях наблюдались очаговая лейкоцитарная инфильтрация гладкого хориона или диффузный гнойно-некротический хориоамнионит с геморрагическим компонентом.
Электронно-микроскопическая картина при гриппе отличается значительной пестротой. В сохранившемся синцитиотрофобласте хорошо развита гранулярная эндоплазматическая сеть. Имеются свободные рибосомы, много митохондрий. Встречается пластинчатый комплекс. Ядерные мембраны четко контурированы, распределение хроматина равномерное. В других участках синцития выявляются дистрофические и деструктивные изменения с разрушением цитоплазматических структур. Базальная мембрана трофобласта имеет обычное строение, местами утолщена, гомогенизирована, неравномерно осмиофильная. Базальная мембрана капилляров неравномерна по толщине и электронной плотности. Клетки эндотелия капилляров содержат на свободной поверхности микроворсины различной толщины, частично со значительными деструктивными изменениями.
Деструктивные изменения ультраструктур плацентарного барьера выявлены при выделении из плаценты вирусов герпеса, цитомегалии, урогенитальной инфекции, гриппа и парагриппа, аденовируса, реовирусов, респираторно-синиитиального вируса и их комбинаций (Красовский Е. Б. и др., 1976). Обнаружено также увеличение количества полисом в эндотелии капилляров ворсин.
Для внутриутробных бактериальных инфекций в плаценте наиболее типична картина листериоза. Возбудителем являются листерии — мелкие грамположительные палочки (в тканях они могут быть грамотри-дательными). В плаценте не всегда можно четко определить стадию развития листериозных очажков (гранулематозная, гранулематозно-некротическая, экссудативно-некротическая, стадия организации и рубцевания). Чаще обнаруживаются обширные лейкоцитарно-гистиоцитарные инфильтраты (особенно в крупных ворсинах), мелкие очаги некроза с вовлечением в патологический процесс межворсинчатого пространства. В очагах некроза и воспаления в большом количестве содержатся листерии. Они могут обнаруживаться в фибринозно-некротических массах, расположенных в межворсинчатом пространстве. Микробные эмболы могут встречаться и в капиллярах ворсин. Специфическое поражение в виде листериозных гранулем и диффузная воспалительная инфильтрация выявлены в децидуальной оболочке. Описан листериозный хориоамнионит в виде флегмонозного воспаления при отсутствии поражения базальной плас¬тины. Флегмонозное пропитывание встречается в соединительной студенистой ткани пуповины. Во внутренней оболочке сосудов пуповины могут быть листериозные гранулемы, а в их просветах — тромбы с неспецифической инфильтрацией сосудистой стенки.
При сифилисе плода плацента может быть не изменена, но в случаях тяжелого поражения имеет характерный внешний вид. Плацента большая (масса до 1500 г), бледная, с крупными, четко очерченными дольками. При микроскопическом исследовании строение ткани напоминает плаценту при гемолитической болезни: много не¬зрелых терминальных ворсин крупного диаметра, большое количество клеток Кащенко—Гофбауэра, капилляры располагаются ближе к центру. В строме ворсин и в сосудах имеются элементы эмбрионального кроветворения. Вместе с тем в отличие от гемолитической болезни в строме стволовых ворсин наблюдаются картины облитерирующего эндартериита, периваскулярный склероз и воспалительные инфильтраты с преобладанием сегментоядерных лейкоцитов. Иногда периваскулярные инфильтраты состоят преимущественно из плазматических и лимфоидных клеток. В пуповине обнаруживаются диффузные лейкоцитарные инфильтраты и отек, расплавление стенки вены. Бледные трепонемы в плаценте выявляются редко, причем в пуповине чаще, чем в плаценте. В целом изменения плаценты при сифилисе не являются очень специфичными, и диагноз можно подтвердить только при нахождении бледных трепонем.
При туберкулезе в первую очередь поражаются децидуальная оболочка и перегородки, где обнаруживают некротические экссудативные и продуктивные очажки. При распространении процесса на межворсинчатое пространство наблюдается образование тромбов с деструкцией эпителия близлежащих ворсин и появление в их строме бугорков — очагов творожистого некроза. Однако чаще в плаценте встречаются неспецифические изменения: тромбоз межворсинчатого пространства, кровоизлияния в базальной пластине, фиброз стромы ворсин и пролиферация их клеточных элементов. Изредка поражается пуповина с некротическими изменениями стенок сосудов и появлением бугорков, содержащих гигантские клетки.
Поражение плаценты при бруцеллезе возникает редко. Воспалительные изменения из эндометрия распространяются в базальную мембрану, где наблюдаются отек, некрозы и лейкоцитарная инфильтрация. Некробиотическим изменениям подвергаются ворсины, расположенные в базальных отделах плаценты.
Поражение плаценты другими бактериями (стрептококк, стафилококк, эшерихии и т. д.) носит характер неспецифического воспаления. В последнее время участились сообщения о внутриутробном заражении стрептококком В с развитием картины тяжелого сепсиса новорожденного в первые 2 сут после рождения. Стрептококк В, как и стрептококк других групп (А, С, D), выделяют из зева матери, прямой кишки и уретры. При изучении влияния стрептококковых заболеваний и носительства стрептококка на течение беременности и плод в бактериологической лаборатории ИАГ АМН СССР выделено 575 штаммов стрептококка у женщин и 345 штаммов у плодов и новорожденных (чаще они относились к группе штаммов D-717) [Башмакова М. А. и др., 1980].
Из паразитарных заболеваний, вызванных простейшими, наиболее подробно изучено внутриутробное инфицирование плода токсоплазмами. При хроническом токсоплазмозе матери вероятность заражения плода невелика, а при заражении женщины во время беременности резко возрастает (до 62%). Плацента при токсоплазмозе характеризуется сочетанием специфических изменений с нарушением созревания. Микроскопически в таких случаях в плаценте обнаруживают группы незрелых ворсин с рыхлой отечной стромой, в которой содержатся клетки Кащенко—Гофбауэра. Синцитиотрофобласт в таких ворсинах широкий; в нем могут располагаться псевдоцисты. В строме ворсин псевдоцисты выявляются гораздо реже. Свободно лежащие токсоплазмы имеются в децидуальной оболочке и в очагах некроза внутри ворсин. В очагах некроза могут содержаться глыбки извести, а в строме ворсин — скопления плазмоцитов. При врожденном токсоплазмозе возникают кровоизлияния в строму ворсин и в межворсинчатое пространство.
Большая отечная плацента может быть при врожденной малярии. В таких случаях большое количество возбудителей обнаруживается в межворсинчатом пространстве. В макрофагах найден малярийный пигмент. В плаценте при малярии имеются очаги некроза, отек и отложения извести.
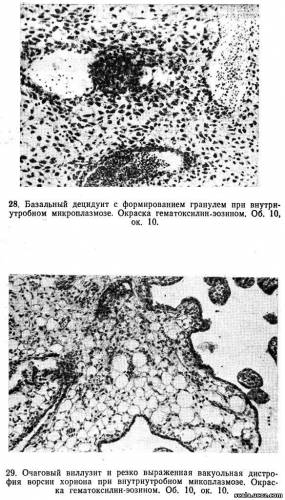
Частыми обитателями мочеполового тракта являются микоплазмы (Mycoplama hominis), интерес к которым как к возбудителям внутриутробной инфекции значительно возрос в последние годы. Инфицирование микоплазмами чаще всего происходит восходящим путем и гематогенно. При изучении плацент в случаях выделения Мус. hominis из их тканей и из органов плода в бактериологической лаборатории ИАГ АМН СССР найдены явления базального децидуита с формированием гранулемоподобных образований, расположенных в стенке сосудов и в периваскулярной ткани (рис. 28). В ветвистом хорионе обнаружены группы крупных и средних ворсин, содержащих аналогичные образования, но меньших размеров. Строма таких ворсин имела вид «пчелиных сот» благодаря резко выраженной вакуольной дистрофии (рис. 29). В различных отделах стромы ворсин наблюдались очаговые кровоизлияния, а в межворсинчатом пространстве — тромбозы.
К возбудителям внутриутробной инфекции в последнее время относят хламидии, вызывающие воспалительный процесс в половых органах взрослых людей, а также заболевания глаз и дыхательных путей у новорожденных. Описан трансплацентарный путь распространения хламидийной инфекции [Wiet J. G. et al., 1976]. Однако изменения плаценты при внутриутробном хламидиозе в литературе не описаны. В литературе имеются сообщения о внутриутробном поражении плода дрожжеподобными грибками рода кандида. При этом отмечается возможность трансплацентарного перехода этих возбудителей [Хмельницкий О. К., Белянин В. Л., 1981].